AIが設計したDNAスイッチで遺伝子をオン/オフできる
Article
カテゴリー:遺伝
この新しい方法は、特定の組織の遺伝子の正確な活性化や抑制を可能にすることで、遺伝子治療やバイオテクノロジーに革命をもたらす可能性がある。
【メイン州バーハーバー 2024年10月23日】ジャクソン研究所(JAX)、MITとハーバード大学の研究機関であるブロード研究所、エール大学の研究者たちは、人工知能を使用して、さまざまな細胞タイプにおける遺伝子の発現を正確に制御できる数千の新しいDNAスイッチを設計しました。この新しいアプローチにより、人間の健康と医学研究のために、体内で遺伝子が発現する時期と位置を、これまでは実現できなかった水準で制御する可能性の扉が開かれます。
「AIで設計したこれらのスイッチの特別な点は、意図された標的細胞の種類に対して顕著な特異性を示すことです。これにより、体の他の部分に影響を与えることなく、たった一つの組織で遺伝子の発現量を増減させる機会が生まれます」と語るのは、この研究の共同上席著者であり、ジャクソン研究所のAssociate Professorでもある Dr. Ryan Tewhey (ライアン・テューヒー)です。
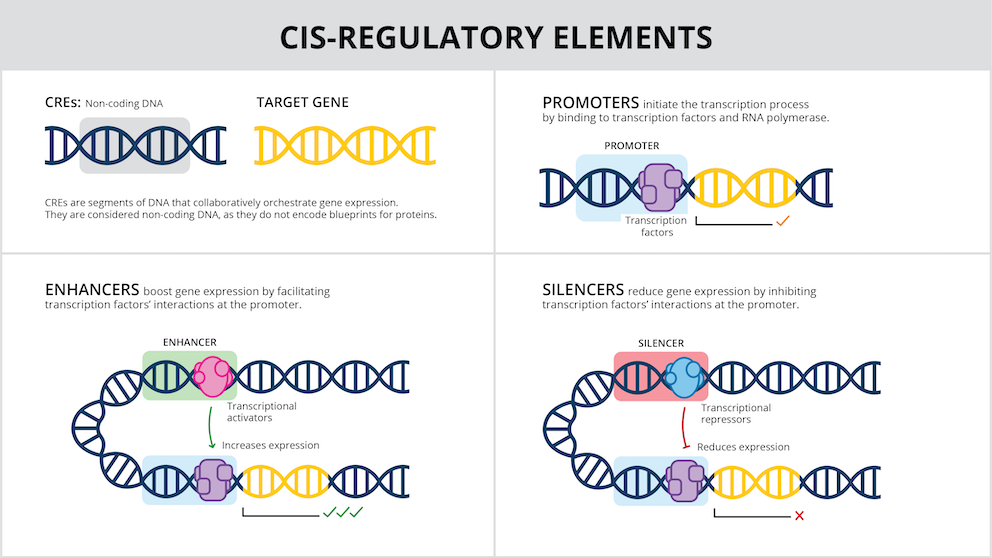
近年、遺伝子編集技術や他の遺伝子治療のアプローチにより、科学者たちは生きた細胞内の遺伝子を変異させることができるようになりました。しかし、生物の全身ではなく、特定の細胞タイプまたは組織内の遺伝子にのみ影響を与えることは困難でした。その原因の一つは、遺伝子の発現と抑制を制御するシス調節要素(CRE)と呼ばれるDNAスイッチに関する理解が道半ばであるためです。
10月23日発行の
Nature
オンライン先行公開版に掲載された論文で、Dr.テューヒーと共同研究グループは、これまでにない新しい合成CREを設計しただけでなく、そのCREを使用して、他の種類の細胞でそれらの遺伝子のスイッチを入れることなく、脳、肝臓、血液細胞の遺伝子を活性化することに成功しました。
組織と時期に応じた指示
生物の細胞に含まれている遺伝子はすべての細胞で同じですが、すべての遺伝子がすべての細胞において、あるいは常に必要というわけではありません。CREは、例えば、脳に必要な遺伝子が皮膚細胞で使用されないようにしたり、初期の発達に必要な遺伝子が成人で活性化されないようにしたりする働きがあります。CRE自体は遺伝子の一部ではなく、独立した制御DNA配列であり、多くの場合、制御する遺伝子の近くに存在します。
科学者たちは、ヒトゲノムには数千種類のCREが存在し、それぞれが少しずつ異なる役割を担っていることを知っています。しかし、CREの仕組みは解明が困難です。「各CREの行動を制御する明確なルールがないのです。そのため、人体の特定の細胞タイプにのみ作用する遺伝子治療を設計するうえで制限が生まれるのです」と、JAXのDr.テューヒー研究室の計算科学者で、この新しい論文の共同上席著者である Dr. Rodrigo Castro (ロドリゴ・カストロ)は説明しています。
「このプロジェクトの本質は、『これらの調節要素のコードの読み書きを私たちは学習できるだろうか?』という疑問です。言語の観点から考えると、これらの要素の文法と構文はほとんど理解されていません。そこで、私たちは、自力で学習するよりも複雑なコードを学習できる機械学習の手法を構築しようと考えました」と、エール大学の遺伝学助教授で、この研究の上席著者の一人である Dr. Steven Reilly (スティーブン・ライリー)は述べています。
研究チームは、ディープラーニングと呼ばれる人工知能(AI)の一種を活用して、血液、肝臓、脳の3種類の細胞におけるCRE活性を研究室で測定した、ヒトゲノムの数十万のDNA配列を使用してAIモデルをトレーニングしました。このAIモデルにより、研究チームは、ほぼ無限の組み合わせから任意の配列の活性を予測することができました。これらの予測を分析したところ、DNAの新しいパターンが発見され、DNA内のCRE配列の仕組みが、遺伝子が活性化される量の指標となるRNAの生成量にどのように影響するかを知ることができました。
その後、研究の共同上席著者であり、ブロード研究所の中核メンバーでハーバード大学教授でもある Dr. Pardis Sabeti, MD, DPhil (パーディス・サベティ)を含む研究チームは、CODA(DNA活性の計算最適化)と呼ばれるプラットフォームを開発しました。CODAは、先ほどのAIモデルを使用して、人間の肝細胞内の特定の遺伝子を活性化するが、人間の血液や脳細胞内の同じ遺伝子を活性化しないなど、求められる特性を持つ何千ものまったく新しいCREを効率的に設計することができます。研究者たちは、「ウェット」研究と「ドライ」研究を繰り返し組み合わせ、実験データを使用してまず計算モデルを構築し、次に検証することで、各CREの生物学的影響二関するプログラムの予測能力を改善し、自然界でこれまで見られなかった特定のCREの設計を可能にしました。
「天然のCREは豊富にありますが、それは存在し得る遺伝子成分のごく一部に過ぎず、その機能は自然淘汰によって制限されています。私たちのAIツールは、淘汰圧力の範囲外にあるバイオものづくりやバイオ医薬品などの新しい用途のために遺伝子発現を正確に調整する遺伝子スイッチを設計する大きな可能性を秘めています」と、Dr.サベティ研究室の博士研究員で、本研究の共同上席著者であるDr. Sager Gosaiは述べました。
臓器を選ぶ
Dr.テューヒーと研究チームは、AIが設計した新しい合成CREを細胞に加え、目的の細胞タイプで遺伝子をどの程度活性化するか、また他の細胞での遺伝子発現をどの程度回避できるかを測定しました。彼らは新しいCREが、目的の細胞タイプに関連することが知られている天然のCREよりもさらに細胞タイプに特異性があることを発見しました。
「合成CREは天然の要素とは意味的に大きく異なるため、その有効性を予測するのは不可能だと思われていました。当初は、その配列の多くが生きた細胞内では異常な働きをするだろうと予想していました」とDr. Gosaiは語りました。
「CODAがこれらの要素をいかにうまく設計しているかを知り、私たちは驚嘆しました」とDr.カストロは語りました。
Dr.テューヒーと共同研究チームは、合成CREが天然のCREよりも優れた性能を発揮できる理由を検討し、細胞特異的な合成CREには、標的細胞タイプで遺伝子を発現させる配列の組み合わせと、他の細胞タイプで遺伝子を抑制する(スイッチをオフにする)配列が含まれていることを発見しました。
最後に、研究チームはゼブラフィッシュとマウスで合成CRE配列のいくつかをテストし、良好な結果を得ました。例えば、あるCREは、成長中のゼブラフィッシュの肝臓で蛍光タンパク質を活性化しましたが、他の部分では活性化しませんでした。
「この技術は、機能があらかじめ定義された新しい調節要素を作る道筋を開くものです。このようなツールは基礎研究にとって価値あるだけでなく、これらの要素を使用して治療目的で特定の細胞タイプに的を絞って遺伝子発現を制御できるなど、生物医学的にも重要な意味を持つ可能性があります」とDr.テューヒーは語っています。
ジャクソン研究所について
ジャクソン研究所は独立した非営利の生物医学研究機関であり、米国国立癌研究所指定のがんセンターを有し、米国、日本、中国の各地に約3,000名の従業員を擁しています。その使命は、疾患に対する精密なゲノムソリューションを探索し、世界中の生物医学コミュニティに活力を与えることです。その根底にあるのは「人々の健康を改善したい」という私たち皆の探求心です。詳細については、 www.jax.org をご覧ください。
MITとハーバード大学の研究機関であるブロード研究所について
MITとハーバード大学の研究機関であるブロード研究所は、現代の創造的な科学者が医学を変革できるよう支援するために2004年に設立されました。ブロード研究所は、生命の分子構成要素とそのつながりを解明し、人間の主要な病気の分子的基礎を発見し、診断と治療に対する効果的な新しいアプローチを開発し、知見、ツール、手法、データを科学界全体に公開することを目指しています。
ブロード研究所は、MIT、ハーバード大学、ハーバード大学付属病院、そして先見の明のあるロサンゼルスの慈善家であるイーライ・ブロードとイーディス・L・ブロードによって設立されました。ブロード研究所には、MITとハーバード大学の生物医学研究コミュニティの教授陣、専門スタッフ、学生が所属し、世界40か国以上、100を超える民間および公的機関と連携しています。
JAXメディア担当:Cara McDonough
cara.mcdonough@jax.org
ブロード研究所担当:Karen Zusi-Tran
kzusi@broadinstitute.org
英語原文: Researchers flip genes on and off - The Jackson Laboratory