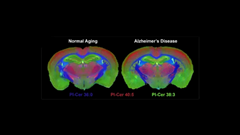
認知症およびアルツハイマー病に対するレジリエンス(回復力)
Research Highlight
【日本語版】
カテゴリー:神経科学
By Mark Wanner
JAX illustration by Karen Davis
アルツハイマー病(AD)については、関連する神経系タンパク質の蓄積、特にアミロイドβプラークとタウタンパクの凝集を予防または軽減することが効果的な治療戦略になるという考えがあります。この考えは理にかなっていますが、この分野での研究努力は、主にアミロイドを減らすことに焦点を当てており、今日まで目立った成果はほとんど得られていません。
そのため、アミロイドとタウはすべてのAD患者の脳に見られるものの、アミロイドやタウを有する多くの人々は認知機能を保持しており、病気に進行しないという点に注目することが重要です。また通常であればADにかかりやすいはずなのに、健康を維持している突然変異を保有している人もいます。機能障害が予想されるにもかかわらず、彼らのニューロンの変性に対するレジリエンス(回復力)、ならびに保護するメカニズムが、集中的に研究されつつあります。
実際に認知症やADに対する感受性が高いにもかかわらずニューロン機能を維持できるということは、症状が現れ始めた後にタンパク質の蓄積を削減または除去する治療よりも効果的な治療を生み出す可能性があると今では考えられています。Trends in Neuroscienceのカバーストーリーとして掲載された「 アルツハイマー病に対するレジリエンスを理解するためのトランスレーショナル・アプローチ 」の中で、ジャクソン研究所(JAX)のAssociate Professorである Dr. キャサリン・カゾロフスキー が率いるチームが、これまでのレジリエンス研究から得られたインサイト(洞察)についてレビューし、レジリエンスベースの治療法につながる可能性のある将来のアプローチを特定しています。共著者には、ファーストオーサーとして、マウントサイナイ医科大学のポスドク研究員であるDr. サラ・ニューナーが含まれています。彼女はDr. カゾロフスキーのラボで大学院の研究を修了しました。また、ヒトのADレジリエンスの第一人者であるヴァンダービルト大学のDr. ティモシー・ホーマンも共著者に名を連ねています。
アルツハイマー病に対するレジリエンスの要因
認知症やADの人の脳とレジリエンスのある人の脳の間には測定可能な違いがあります。 当然のことながら、レジリエンスのある人は、認知症の人と比較して、長い期間、多くのニューロンとシナプス結合を保持しています。また、樹状突起スパイン密度などの重要な脳の構造が継続して維持されるという顕著な特徴もあります。興味深いことに、レジリエンスは、脳内の炎症とミクログリアの動員(ミクログリアは中枢神経系内の免疫細胞)の抑制を示すユニークなサイトカイン(免疫シグナル伝達)プロファイルにも関連しています。
遺伝的な要素もあります。場合によっては、特定のPSEN1突然変異やダブルAPOE4遺伝子型などの遺伝的特徴が、疾患に対する遺伝的素因の影響を変化させる可能性があります。 また、いくつかの遺伝的メカニズムもレジリエンスに関連付けられています。例えば、免疫シグナル伝達、細胞粘着、アミノ酸代謝などとの関連です。タンパク質レベルでは、シナプス機能と可塑性に重要な役割を果たすことが知られているタンパク質であるNRN1は、シナプスタンパク質MAP3とSEMA7Aのレベル低下と同様に、レジリエンスと強く関連しています。そしてオミックス技術がよりパワフルかつ費用効果が高くなるにつれて、ヒトのサンプルにおける、さらなるレジリエンスの測定基準と特性を特定するための多くの研究が可能になりました。
認知症レジリエンス研究のための動物モデル
死後まで脳組織にアクセスできないことや、正確な遺伝的特徴を操作できないことなど、ヒトの研究には重要な制限があります。したがって、マウスはレジリエンスの研究においてヒトを補完する重要な実験的要素です。また近年の遺伝子技術の進歩により、ゲノムを操作してヒトのADモデルを作製することが比較的容易になっています。遺伝的参照パネルも、レジリエンス研究に遺伝的多様性を組み込んでおり、さまざまなレベルのレジリエンスに関連する遺伝子をマッピングするための重要なツールになりつつあります。Dr. ニューナーによって開発された遺伝的に多様なマウスパネルであるAD-BXDは、原因となる突然変異の存在下で疾患に対する感受性が変動することを示し、研究者が複数の遺伝的ADリスク因子とAD感受性の修飾因子を同定できるようにしました。
さらに、マウスを使用して、レジリエンスに関連するヒトの特性をより詳細に調べることができます。たとえば、樹状突起スパインの保有はレジリエンスのある人々に一貫して見られますが、アミロイドβやタウタンパクの存在下で、実際にどのようなメカニズムや経路でスパインが失われるのでしょうか? 研究者は、スパインの喪失に関連する分子カスケードを特定しました。これが抑制されると、スパインの完全性が維持されます。またヒトの集団では、アミロイドとタウの蓄積が同程度の女性と比較して、男性は認知機能がより低下し、神経変性が多く、死亡も多く見られますが、これは何故なのでしょうか? 研究者らは、X染色体上の遺伝子であるKdm6aが、脳内で過剰発現したときに保護作用を発揮することを突き止め、レジリエンスを高める重要なドライバー(推進力)である可能性を示しました。
アルツハイマー病研究の今後の方向性
ヒトの病気をよりよく再現するマウスモデルと遺伝的に多様なマウスパネルによって、レジリエンスを含むAD研究の多くの領域において新しいインサイトがもたらされています。マウスは、遺伝的性質と収容環境の変数を制御することにより、ライフスタイルの要因(食事、身体活動、認知機能の強化など)がADに対する感受性とレジリエンスにどのように影響するかを研究する機会も提供します。ただしヒトとマウスの研究を統合し、調査結果をヒトの医学に置き換えることは依然として難しいものがあります。そのため、臨床の進歩と効果的なAD予防法および治療法の開発につながる可能性のある継続的なインサイトに必要なデータを提供するために、ハイスループットツールの開発を続けることが不可欠なのです。
英語原文
https://www.jax.org/news-and-insights/2022/march/resilience-to-dementia-and-ad