なぜ医薬品開発者は抗体医薬品候補をヒト化マウスで試験するのでしょうか?
Blog Post
カテゴリー:ヒト化マウス
By Adriano Flora
ヒト化マウスは、ヒトの遺伝子または細胞を保有する動物として定義され、医薬品開発分野では比較的新しいものです。規制機関はヒト化マウスで生成されたデータを用いたIND申請(新薬臨床試験開始申請)を日常的に受け入れていますが、その新規性により、既存の前臨床モデルから置き換えることを推奨するにはまだ至っていません。さらに、これらのモデルの使用について調和を図ろうとする取組みが行われているものの、この分野ではいまだ足並みが揃っておらず、IND申請のための実験にヒト化モデルをいつ、どのように使用するかについてのコンセンサスはありません。このように、ヒト化マウスに関連する規制状況は複雑で、技術的にも複雑です。それなのに、なぜ医薬品開発者は、in vitroによる手法、野生型のマウス、ラット、サル(NHP)など、従来の使い慣れたツールではなくヒト化マウスに注目しているのでしょうか?
答えは簡単です。ヒト化マウスを使用すれば、医薬品候補が臨床でどのように作用するかを予測でき、医薬品開発者はヒトで試験する前にリード分子を微調整して毒性を軽減し、有効性を高めることができるからです。多くの査読論文や学術会議の発表で証明されているように*1,2,3、大手製薬企業はこれらのツールを広範囲に検証し、自社の開発パイプラインに適用しています。 次の段落では、これらの医薬品開発者が開発プログラムを進めるために、ヒト化モデルをどのように使用したか、いくつかの事例を見ていきます。
ファースト・イン・ヒューマン
革新的なフォーマットに取り組んでいる前臨床の科学者たちは、ヒトに注射されたことのない分子の臨床PK(薬物動態)を予測するという手ごわい課題に直面しています。問題をさらに複雑にしているのは、ほとんどの大きな分子は、種特異的なタンパク質相互作用に依存する能動的なメカニズムによって血液から除去されてしまうことです。2 つのよく知られた例は、IgGベースの分子とアルブミン結合分子で、これらは新生児Fc 受容体(FcRn)との相互作用を通じてリサイクルされます。進化的分岐の結果として、FcRnに対するこれらの化合物の相対的な親和性は種間で大きく異なります。この問題を克服するために、トランスレーショナル研究分野の科学者たちは、マウスゲノムを改変して、マウスのFcRnをヒトの FcRnに置き換える可能性を見出してきました*4,5。
サノフィは、FcRnによるリサイクルのメカニズムを利用して半減期を延長する人工分子の開発において最前線にいる企業です。数ある大手製薬企業の中でも、サノフィのDMPK(薬物代謝・薬物動態)グループは、FcRnトランスジェニックマウスモデルを、Fcサイレンシングされたモノクローナル抗体、二重特異性抗体、および三重特異性抗体のPKを予測するためにうまく使用できることを示し*6,7、ファースト・イン・ヒューマン試験において用量を合理的に選択する道筋を開きました。
特異性という両刃の剣
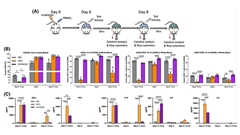
抗体の特異性が高いほど、オフターゲット効果を生じる可能性が低くなります。ただし、ヒトのエピトープに対する特異性が高いと、通常、前臨床試験に一般的に使用される動物種の相同タンパク質との交差反応が生じません。毒性と有効性を試験するためのin vivoの試験系が存在しないため、より信頼性の高い治療域の推定を必要とする臨床試験へまでの道のりが非常に複雑になります。例として、CD19xCD28二重特異性抗体であるRG6333が挙げられます*8。CD28を標的とする抗体であるTGN1412により、臨床試験で6名が重篤な状態になったため、CD28は高リスクの標的と考えられています。RG6333のCD28と結合する腕はげっ歯類やNHP(サル)と交差反応しないため、開発者たちはヒト化マウスで潜在的な毒性を試験することを決定し、TGN1412と比較してその安全性を実証しました。このアプローチにより、前臨床グループは規制要件を満たし、臨床試験での用法用量を選択するうえでの理論的根拠を提案することができました。
組み合わせが未来を創る
腫瘍生物学のさまざまな側面に対して、薬剤を組み合わせることによってのみ効果的な治療法を開発できるということに疑問を抱く臨床医はほとんどいません。しかし、2つ以上の薬剤の同時投与は、最適な治療域を見つける必要がある臨床の科学者にとって大きな課題となります。ロシュの研究者は、ヒト化マウスを使用して、二重特異性抗体と小分子、チェックポイント阻害剤、その他の二重特異性抗体の組み合わせをテストしました*9,10。ヒト化モデルを使用することで、前臨床の科学者たちはさまざまな用量でのさまざまな組み合わせの有効性を評価し、最適な治療域が得られる最適な用量について臨床研究者に知らせることができます。
第一に、害を及ぼさないこと
臨床医の一番の使命は、治療のベネフィットを無くしてしまう毒性を回避することです。ほとんどの免疫療法薬は免疫系を活性化するため、通常は過剰なサイトカイン放出を誘発することにより、過剰な免疫反応を引き起こす危険性があります。医原性サイトカイン放出症候群(CRS)は、現在開発中のほぼすべての免疫療法の最も一般的かつ危険な副作用の1つとして認識されています。医薬品開発者は、CRSを予測する際に2つの大きな障害に直面しています。それは、ヒト以外の種との交差反応性が欠如していることと、患者のばらつきが大きいことです。ヒト化マウスは、これらの問題に対処する最適な解決策であることが証明されています。ヒトにおける標的が発現するため特異性の問題を克服でき、またヒト化する過程で複数のドナーを使用することで、臨床で見られる変動性を反映できます*11。いくつかの論文では、前臨床の研究者が同様のツールを使用して、治療効果を低下させることなく薬剤誘発性CRSに対処する新しいアプローチを特定し、急性免疫毒性に対処するための新しい臨床戦略への道を切り開いたことを示しています*12,13。
関連性を持つことの価値
ヒト化マウスをその用途に合った目的に使用すると、貴重な情報が得られ、臨床試験プロトコルを最適化し、医薬品開発の成功の可能性を最大化することができます。過去数年間に蓄積された知識により、科学者の皆さんは、当初のヒト化マウス系統に遺伝子改変をさらに導入してこれらのモデルの性能を向上させ、忠実度を高めてヒトの免疫系の関連側面を模倣し、トランスレーション研究におけるその価値を高めることができます*14。
監督機関では最近、ほとんどの前臨床試験用の動物種にはトランスレーショナル研究的価値がないとの認識がありますが*15、臨床試験に参加する新しいがん免疫の分子実体の安全性と有効性を確保するには、しっかりとしたin vivoデータが必要であることは依然として広く認識されています。トランスレーショナル研究に関わると考えられている唯一の動物種であるNHP(サル)が不足しているため*16、信頼できるトランスレーショナル研究データを生成し、臨床に導入される新しい分子実体が安全かつ有効であることを確認するには、ヒト化マウスモデルが唯一の実行可能な選択肢になりつつあります。
参考文献
- Pasquiers, B.; Benamara, S.; Felices, M.; Nguyen, L.; Declèves, X. Review of the Existing Translational Pharmacokinetics Modeling Approaches Specific to Monoclonal Antibodies (mAbs) to Support the First-In-Human (FIH) Dose Selection. Int. J. Mol. Sci. 2022, 23, 12754.
https://doi.org/10.3390/ijms232112754 - Novartis Compiles Mouse Avatar "Encyclopedia". Cancer Discov (2016) 6 (1): 5-6.
https://doi.org/10.1158/2159-8290.CD-NB2015-168 - Cristina C. et al. Tumor-targeted 4-1BB agonists for combination with T cell bispecific antibodies as off-the-shelf therapy. Science Translational Medicine 12 Jun 2019 Vol 11, Issue 496
https://doi.org/10.1126/scitranslmed.aav5989 - Proetzel G. and Roopenian D. Humanized FcRn mouse models for evaluating pharmacokinetics of human IgG antibodies. Methods 2014 Volume 65, Issue 1 Pages 148-153.
https://doi.org/10.1016/j.ymeth.2013.07.005 - Avery B.L., et al. Utility of a human FcRn transgenic mouse model in drug discovery for early assessment and prediction of human pharmacokinetics of monoclonal antibodies. 2016 mAbs, 8:6, 1064-1078,
https://doi.org/10.1080/19420862.2016.1193660 - Mackness B.C., et al. Antibody Fc engineering for enhanced neonatal Fc receptor binding and prolonged circulation half-life, mAbs, 2019 11:7, 1276-1288,
https://doi.org/10.1080/19420862.2019.1633883 - Valente D. et al. Pharmacokinetics of novel Fc-engineered monoclonal and multispecific antibodies in cynomolgus monkeys and humanized FcRn transgenic mouse models. mAbs Volume 12, 2020 -Issue 1
https://doi.org/10.1080/19420862.2020.1829337 - Johannes Sam, Thomas Hofer, Christine Kuettel, Christina Claus, Sylvia Herter, Guy Georges, Jenny Tosca Thom, Leo Kunz, Samuel Gebhardt, Florian Limani, Stefanie Briner, Silvia Jenni, Anne Schönle, Marine Le Clech, Ahmet Varol, Esther Bommer, Birte Appelt, Sara Colombetti, Stephan Gasser, Marina Bacac, Christian Klein, Pablo Umana; RG6333 (CD19-CD28), a CD19-Targeted Affinity-Optimized CD28 Bispecific Antibody, Enhances and Prolongs the Anti-Tumor Activity of Glofitamab (CD20-TCB) in Preclinical Models. Blood 2022; 140 (Supplement 1): 3142–3143. doi:
https://doi.org/10.1182/blood-2022-159941 - Johannes Sam, Sara Colombetti, Tanja Fauti, Andreas Roller, Marlene Biehl, Linda Fahrni, Valeria Nicolini, Mario Perro, Tapan Nayak, Esther Bommer, Anne Schoenle, Maria Karagianni, Marine Le Clech, Nathalie Steinhof, Christian Klein, Pablo Umaña and Marina Bacac Combination of T-Cell Bispecific Antibodies With PD-L1 Checkpoint Inhibition Elicits Superior Anti-Tumor Activity Front. Oncol., 30 November 2020 Sec. Cancer Immunity and Immunotherapy Volume 10 - 2020
https://doi.org/10.3389/fonc.2020.575737 - Christian Klein, et al. Targeting Intracellular WT1 in AML Utilizing a T Cell Bispecific Antibody Construct: Augmenting Efficacy through Combination with Lenalidomide. 2019 Blood, Volume 134, Supplement 1, Page 4450, ISSN 0006-4971,
https://doi.org/10.1182/blood-2019-130121 - Ye C., Yang H., Cheng M., Shultz L.D., Greiner D.L., Brehm M.A., Keck J.G. A rapid, sensitive, and reproducible in vivo PBMC humanized murine model for determining therapeutic-related cytokine release syndrome. 2020 FASEB J. Sep;34(9):12963-12975. doi:
https://doi.org/10.1096%2Ffj.202001203R - Gabrielle Leclercq, Nathalie Steinhoff, Hélène Haegel, Donata De Marco, Marina Bacac & Christian Klein Novel strategies for the mitigation of cytokine release syndrome induced by T cell engaging therapies with a focus on the use of kinase inhibitors. 2022 OncoImmunology, 11:1,
https://doi.org/10.1080/2162402X.2022.2083479 - Gabrielle Leclercq-cohen, Marina Bacac & Christian Klein Rationale for combining tyrosine kinase inhibitors and T cell redirecting antibodies to mitigate cytokine release syndrome (CRS). 2023 Expert Opinion on Biological Therapy, 23:3, 223-225, DOI:
https://doi.org/10.1080/14712598.2023.2166786 - Cogels M.M., et al. Humanized Mice as a Valuable Pre-Clinical Model for Cancer Immunotherapy Research. 2021 Front Oncol. Nov 18;11:784947. doi:
https://doi.org/10.3389/fonc.2021.784947 PMID:34869042; PMCID:PMC8636317. - https://www.science.org/content/article/fda-no-longer-needs-require-animal-tests-human-drug-trials
- https://www.science.org/content/article/supply-monkeys-research-crisis-point-u-s-government-report-concludes
英語原文: Why would drug developers test their antibody drug candidates in humanized mice?