ヒト化マウスを使用した複雑な全身性免疫応答の研究
Blog Post
【日本語版】
By James Keck, Ph.D.
ヒト化マウスを使用した複雑な全身性免疫応答の研究
多くの哺乳類は、重要な特徴がヒトと共通する免疫系を持っていますが、ヒトに固有の免疫細胞や免疫現象もあります。そのため、研究者が治療薬、感染症、癌などの免疫反応を引き起こす可能性のある刺激に対する臨床反応を正確に予測するのに役立つ実証研究を計画および実行することは困難でした。特に、サイトカイン放出症候群 (CRS) や、それによって下流で生じる移植片対宿主病 (GvHD) などの免疫系全体に及ぶ免疫障害は、研究、予防、治療が依然として非常に困難な状態が続いています。in vitro 研究では、免疫系がさまざまな組織に及ぼすカスケード効果を捉えることができず、齧歯類やサルなどの動物を対象としたin vivo研究では、これまでヒトに固有の免疫細胞に関連する毒性を予測できていません (Eastwood et al. 2010)。
これらの問題を解決するために、ジャクソン研究所(JAX) は、ヒト免疫系の多様な機能的側面の評価に使用できるマウスモデルの汎用ツールセットを開発しました。これらのマウスは、炎症反応について薬剤候補をスクリーニングするための高感度で再現性のある結果をもたらす前臨床研究プラットフォームを提供します。このプラットフォームは、免疫障害の進行とそれらを治療するための薬の潜在的な有効性についての知見も提供します。
免疫学研究のためのマウスのヒト化
T細胞による免疫応答を研究するためのヒト化マウスプラットフォームを作製するために、ヒトのドナーからの末梢血単核細胞 (PBMC) を免疫不全マウス ( NOD-scid IL2rgnull, or NSG ) に移植しました。PBMC にはさまざまな免疫細胞が含まれますが、この移植モデルでは主にT細胞であり、ヒトT細胞による免疫応答をマウスで再現することができます。 バリデーション試験では、臨床的にCRSを引き起こすことが知られている化合物を使用して、これらのヒト化マウスモデルで用量依存的なCRS応答を確実に誘発できること、臨床的に安全であることが知られている免疫療法に対してCRS応答が生じないことを確認しました。また、個々のヒトPBMCドナーにおけるサイトカイン放出の変動も評価したところ、同じドナーから採取した細胞で実施したin vitroアッセイよりも感度が高く、再現性の高い結果が得られました (Ye et al. 2020)。
CRS が臓器に及ぼす影響の検討
CRSは、免疫系が薬や病気などの刺激に過剰反応したときに発生します。活性化された白血球が過剰なサイトカイン(シグナル伝達タンパク質)とともに体に溢れ、これにより、さらに多くの白血球が活性化され、発熱、臓器不全、さらには死にも至る危険な雪だるま効果を生み出します。
私たちのヒト化マウスモデルでは、薬物投与後に血流に放出されるさまざまなヒトサイトカインのレベルを測定できるだけでなく、これらのサイトカインが下流で体に及ぼす影響を経時的に観察することもできました。体重の変化を観察し、血清を採取して腎臓と肝臓の酵素レベルを分析しました。また、肝臓と肺から組織サンプルを採取し、ヘマトキシリンとエオシン (H&E) 染色、カスパーゼ3染色、ならびに肝細胞の単細胞壊死検出を使用して病理組織学的研究を行いました。
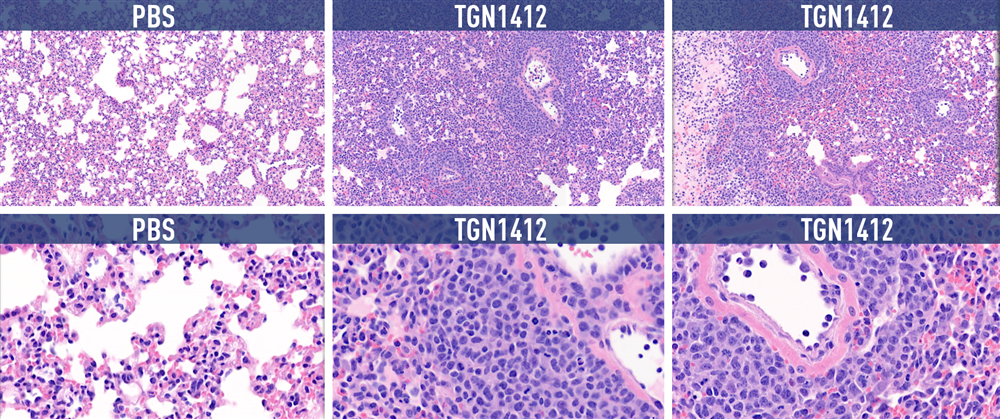
図1. 肺組織のH&E染色による病理組織学的検査の結果。ヒトPBMCを移植したNSGマウスに抗 CD28 mAbおよびTGN1412類縁化合物を投与。どちらもサイトカインの放出を誘導することが知られている。実験組織サンプルの紫色の染色は、細胞死亡率が高いことを示している。
予想どおり、サイトカイン放出レベルに基づいて、CRSを引き起こすことが知られている化合物を投与されたヒト化マウスは、体重の減少を示し、機能を低下させる重度の臓器損傷が起こりました。これらの研究をさらに進めていくことで、投与量の違いなどの要因がCRSの下流臓器への影響をどのように変化させるかをよりよく理解することができます。
GvHD 進行のモデル化
私たちはGvHDをモデル化するためのヒト化マウスも作製しました。GvHDは、CRSを長期間治療せずにいると発生する可能性があり、臓器系全体に影響を及ぼします。これらのモデルは、NSGマウスを放射線で処理してから、ヒトPBMCを移植することで作製しました。これは、私たちが行った他の研究と同様のプロセスです。ただし、この研究のPBMCドナーは、GvHD応答について事前に特性が評価されていることが重要でした。
研究の結果、ヒト化マウスモデルにおけるGvHDの進行と重症度は、個々のPBMCドナーに特異的であり、ヒト移植レシピエントで観察されたGvHD応答の多様性と重症度の範囲を高い精度で反映していることが認められました。これは、CRS と同様に、このプラットフォームを利用して、患者の免疫系が治療にどのように反応するかを個別に予測できる日が来る可能性があることを示しています。
GvHDなどの免疫関連の移植合併症を治療するための新薬の前臨床試験のためのこのプラットフォームの有用性を実証するために、最初の研究を行いました。このモデルを使用して、GvHDの進行を遅らせることが知られている免疫調節剤であるAbataceptと、同じ効果を発揮するようにデザインされた二重特異性抗体(高用量および低用量)を比較しました。

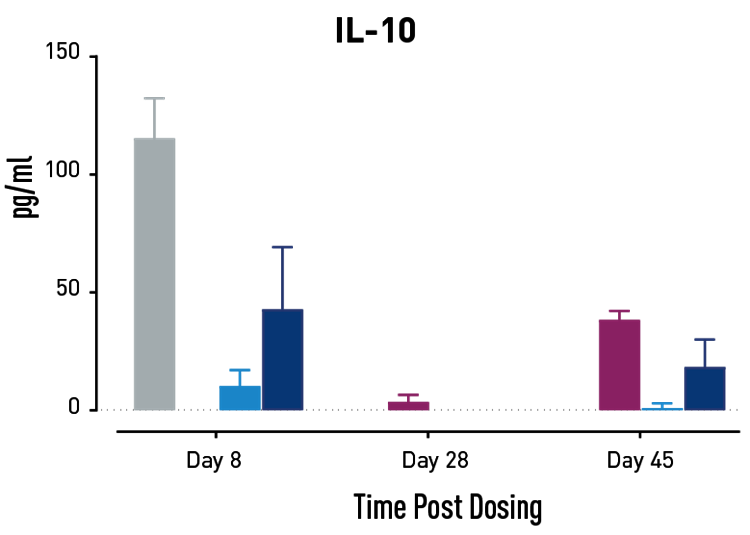
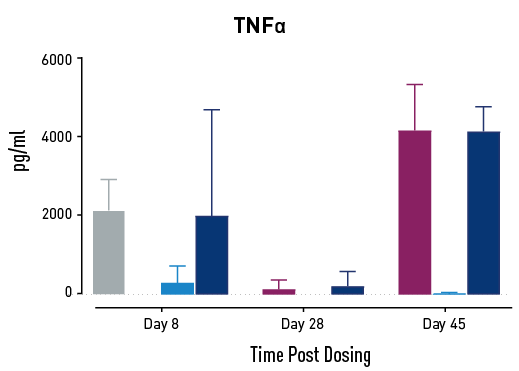
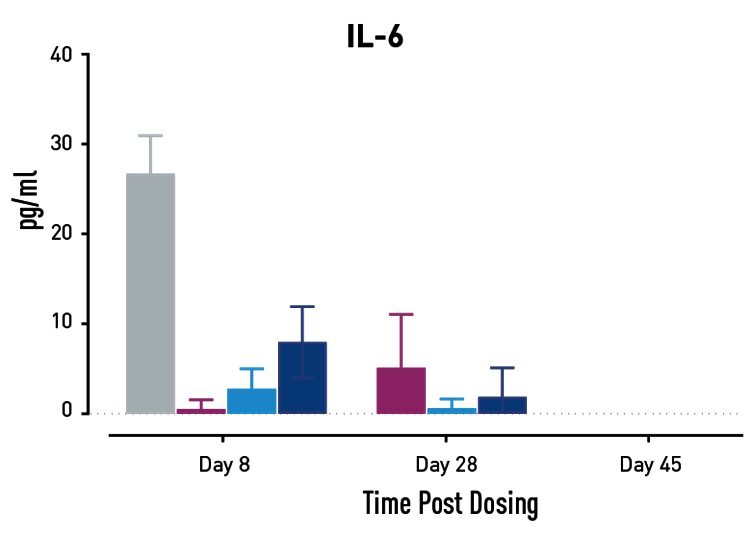

図2. GvHD進行中のサイトカインの測定結果。GvHDモデルとなるヒトPBMC移植NSGマウスに、Abataceptまたは低用量または高用量の二重特異性抗体を投与。高濃度の二重特異性抗体を投与されたマウスでは、試験28日目と45日目にAbataceptを投与されたマウスよりもサイトカイン放出量が少なかった。
GvHDを有するヒトにAbataceptを投与すると、T細胞の増殖とサイトカインの放出が減少し、生存率が改善します。対照群と比較して、Abataceptと二重特異性抗体の投与量の両方が、これらの3つの効果をすべて示しました。高用量の二重特異性抗体は、研究の後半でAbataceptよりも優れた効果を示しました。この結果は、このヒト化マウスプラットフォームが、GvHDの治療を目的とした新薬の有効性と作用機序の微妙な差異に関する情報を提供できることを示しています。
基礎研究から医薬品パイプラインまで、免疫応答を研究するためのJAXの最先端のヒト化マウスプラットフォームの詳細については、 CRS Evaluation Studyページ をご覧ください。
参考文献