乳がんの肺転移において間葉系細胞が果たす複数の役割
Research Highlight
カテゴリー:がん
By Mark Wanner
がんによる死亡のほとんどは、原発腫瘍の増殖によるものではなく、その後の体内でのがんの広がり、つまり転移と呼ばれるプロセスによるものです。原発腫瘍から離れ、血流を通過し、最終的に新しい臓器や組織に定着するまで生き残ることができる細胞はわずかですが、肺などのがん細胞が転移しやすい環境も存在します。
ジャクソン研究所 (JAX) Assistant Professorの Dr. Guangwen “Gary” Ren (グワンウェン・「ゲーリー」・レン)は、遠隔臓器における転移性腫瘍増殖の根底にあるメカニズムを調査し、予防と治療の両方の介入にとって可能性のある分子標的の特定に取り組んでいます。
Dr.レンと彼のチームによる最近の2つの論文は、肺における間葉系細胞 (MC) のさまざまな側面と、MCが乳房腫瘍細胞の肺への転移をどのように助長するかに焦点を当てています。大部分が線維芽細胞であるMCは、通常、さまざまな種類の組織の構造の形成に関与しており、損傷時の組織再生に不可欠な細胞です。肺では、MC は肺の初期発生に重要な調節的役割を果たし、さまざまな条件下で肺の安定性を維持します。しかしながら、固形がんの肺転移におけるMCの役割は、あまり特徴付けられていません。この新しい研究では、MCが肺内部の免疫抑制を促進し、脂質という燃料を転移細胞に提供している可能性があることを示しました。どちらも、腫瘍細胞が生き残り、成長して転移を成功させるのに役立ちます。
間違った方向に送り込まれる脂質
Cell Metabolismに掲載された 最初の論文では、Dr.レンと共同研究者 (JAX Professorの Dr. Lenny Shultz ⦅レニー・シュルツ⦆とJAX ProfessorでありPresident Emeritusの Dr. Edison Liu ⦅エディソン・リュー⦆を含む)が、肺のMCに脂質がどのように蓄積されるかを見極めるために、乳がんモデルを使用した研究が詳述されています。「Lipid-laden lung mesenchymal cells foster breast cancer metastasis via metabolic reprogramming of tumor cells and natural killer cells(脂質を含んだ肺間葉系細胞は、腫瘍細胞とナチュラルキラー細胞の代謝リプログラミングを介して乳癌転移を促進する)」と題されたその論文は、肺MCにおける脂質蓄積がIL-1βシグナル伝達によって制御される分子経路の結果であることを明らかにしています。脂質を含んだMCは脂質を腫瘍細胞に送り込み、腫瘍細胞の生存率を高め、ナチュラル キラー(NK)細胞の機能不全を引き起こします。この組み合わせによって乳がんの肺転移が促進されるため、IL-1βをブロックすることでNK細胞ベースの免疫療法の有効性が向上しました。
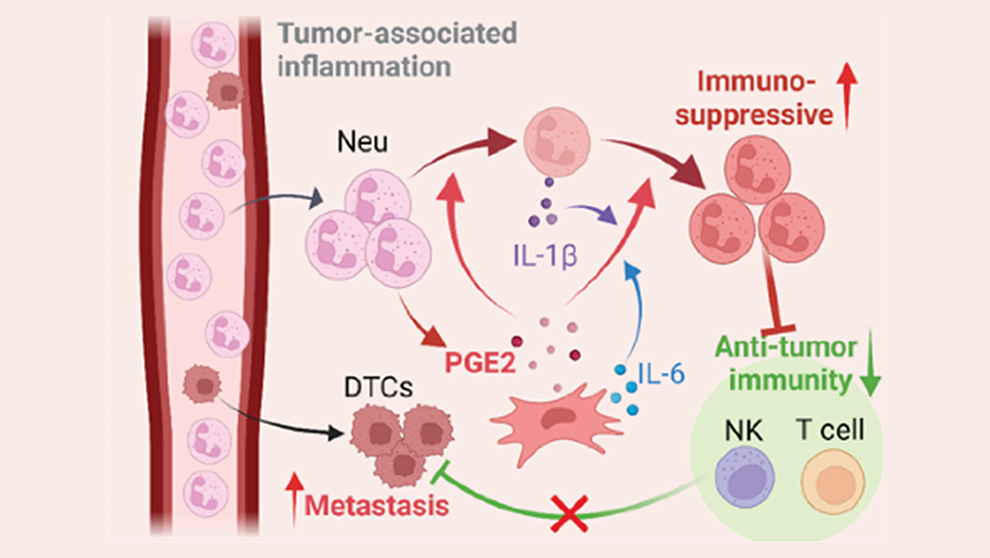
免疫を抑制する好中球
関連する研究で、Dr.レンとDr.シュルツならびに研究チームは、間葉細胞が肺組織に腫瘍細胞が転移しやすくする別の方法、すなわち免疫抑制について調査しました。この方法では、肺MCの特定のサブセットが、重要なタイプの免疫細胞である好中球の免疫抑制活性を高めます。好中球は最も豊富な自然免疫細胞であり、通常は病原性微生物に対する防御の最前線として機能します。しかし、がんでは、転移巣の微小環境内での関与するメカニズムはまだよく理解されていませんが、好中球が実際にがんの増殖を促進し、抗腫瘍免疫応答を抑制することが示されています。 Science Immunologyに掲載されたばかりの 「Immunosuppressive reprogramming of neutrophils by lung mesenchymal cells promotes breast cancer metastasis(肺間葉細胞による好中球の免疫抑制的リプログラミングが乳癌転移を促進する)」で、Dr.レンと彼のチームは特殊なマウスモデルとヒト細胞培養を使用して、間葉細胞が肺において好中球による免疫抑制の原因となっており、浸潤がん細胞の生存率を高めることを示しています。
研究チームは最初に、好中球が他の組織でも免疫抑制性を示すのか、それとも肺でだけなのかを調べました。脾臓、骨髄、または血液から分離された好中球は、肺から分離されたものよりもはるかに免疫抑制性が低いことがわかりました。そして肺において好中球は、腫瘍の存在下と腫瘍のないナイーブマウスの両方で免疫抑制性を示しました。興味深いことに、骨髄由来の好中球を肺や他の組織に導入すると、肺に導入した好中球でのみ免疫抑制関連遺伝子の発現が大幅に増加し、肺に特異的なリプログラミングメカニズムの存在が示唆されました。
間葉系細胞の影響
では肺の中で、好中球が強力な免疫抑制性を発揮するようリプログラミングする原因となっているものは、何なのでしょうか? 研究チームは、どの細胞サブセットが変化を促進したかを確認するために、骨髄由来の好中球とともに肺間質細胞を培養しました。彼らは、免疫抑制関連遺伝子の好中球発現を有意に増加させるCD140a+(主に線維芽細胞)という種類のMCを特定しました。CD140a+細胞は他の組織にも存在しますが、肺に存在するCD140a+細胞が最も顕著な影響を及ぼすことがわかりました。リプログラミングはMCと好中球の接触に依存しないため、研究チームは、可溶性因子がシグナル伝達経路を介して、強力に免疫が抑制された状態を誘発すると仮定しました。さらに調査を行った結果、肺のMCによって産生される炎症性脂質メディエーターであるプロスタグランジンE2 (PGE2)が、主要な原因分子であることを突き止めました。
免疫抑制性を示している好中球は、T細胞とNK細胞の抗腫瘍細胞活性を阻害します。これらも、本来であれば原発腫瘍から分離したがん細胞を通常は検出して排除する免疫細胞です。 しかし、好中球の免疫抑制がブロックされた場合、通常の監視および排除免疫機能が再開し、転移を防ぐことができるでしょうか? 研究チームは、PGE2欠乏症を有する改変マウスを使用して、肺のT細胞増殖とNK細胞機能が野生型マウスほど抑制されておらず、肺転移のレベルが低いことを発見しました。次に、2つのPGE2受容体であるEP2とEP4を薬理学的にブロックして、PGE2シグナル伝達を阻害したところ、同様の結果が認められました。
がんの肺転移巣の治療
この発見は、がんの肺転移の発生を減らすための治療法の開発に重要な意味を持っています。免疫療法では、多くの場合、がん細胞を攻撃するようにT細胞を操作または活性化しますが、そのような戦略は、免疫抑制環境下ではかなり効果が低く、研究チームは、そのような治療法の1つであるT細胞による養子免疫療法は、肺転移の治療においては効果を失うことを確認しました。しかしながら、上記のように PGE2受容体を遮断することで有効な治療が可能になり、致死的な肺転移を治療するための効果的な併用療法の可能性が示されました。
著者:
Mark Wanner
米国ジャクソン研究所Research Communications部門Associate DirectorのMark Wannerは、ジャクソン研究所の研究に関するコミュニケーションを統括しています。 サイエンスとコミュニケーション両方のバックグラウンドを持つMark Wannerは、さまざまな媒体で生物医学と臨床科学の問題を取り上げ、それらの情報を多くの視聴者層に発信するとともに、その問題について説明しています。
英語原文: Multiple roles for mesenchymal cells in lung metastasis of breast cancer