遺伝がアルツハイマー病にどのような影響を与えるかを研究する
Research Highlight
カテゴリー:神経科学
By Mark Wanner
臨床におけるアルツハイマー病(AD)の診断は、間接的な指標に基づいて行われることが多く、初期段階では特にその傾向が顕著です。何十年もの間、確定診断は死後でなければ行うことはできませんでした。現在、さまざまな認知機能検査と脳脊髄液中のアルツハイマー病に関連するタンパク質の測定により、かなり信頼度の高い診断指標を得ることができます。それらの指標は、高度な画像技術を使用した脳スキャンによってさらに裏付けられます。
しかし、ADを迅速かつ正確に診断することがこれほど難しいのは何故なのでしょうか? その理由の1つは、主にベータアミロイド斑やタウ病変といった脳内のタンパク質の蓄積を除き、アルツハイマー病の発症と進行に関与する重要な生物学的プロセスの多くが依然として不明であることです。また、最近の研究では、ADには遺伝的に定義された異なるサブタイプが存在する可能性が高いことが示されています。また、同一の稀で高リスクの遺伝子変異がある場合でも、人によって発症のタイミングや重症度が異なることが明らかになり、遺伝的な背景がアルツハイマー病の病態において重要な役割を果たしていることが示唆されています。
ジャクソン研究所(JAX)のAssistant Professorの Dr. Erik Bloss (エリック・ブロス)とProfessorの Dr. Gareth Howell (ギャレス・ハウエル)が率いる研究チームは、多様な遺伝的背景を持つアルツハイマー病のマウスモデルを用いて、異なる遺伝的背景が初期段階のADにおいて、その神経回路にどのような影響を与えるかを調査しました。ハウエル研究室とブロス研究室のPredoctoral Associateである筆頭著者Sarah Heuer(サラ・ホイヤー)も参加した研究チームは、アルツハイマー病で障害されやすい特定の神経投射経路におけるシナプスの変化が、実際には遺伝的背景により異なる制御を受けていることを実証しました。この研究結果は、「Control of hippocampal synaptic plasticity by microglia-dendrite interactions depends on genetic context in mouse models of Alzheimer’s disease(ミクログリアと樹状突起の相互作用による海馬シナプス可塑性の制御は、アルツハイマー病マウスモデルにおける遺伝的背景に依存する)」で発表され、この論文は米国アルツハイマー病協会のジャーナル Alzheimer’s & Dementia に掲載されました。
回復力の高いマウス
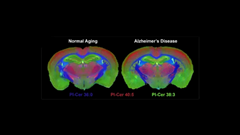
ADの基礎生物学に関するほとんどの研究は、C57BL/6J(略してB6)という近交系マウスを使用して行われています。1つのマウス系統を使った研究は、同じ遺伝的背景におけるADの病態を研究するのには非常に有用ですが、同じ遺伝子変異またはADリスク因子を持つ異なる人々がさまざまな症状を示す理由についての答えは得られません。そこで研究チームは、B6とは著しく異なる遺伝的背景を持つPWK/PhJ(PWK)という野生由来のマウス系統を追加しました。研究チームはこれまでに、2つの重要なヒト化アルツハイマー病関連遺伝子であるAPPとPSEN1(PWK.APP/PS1)に変異があるPWKマウスと、一般的に研究に使用されているB6.APP/PS1マウスに同一のβアミロイド斑の沈着が現れることを明らかにしていました。それにもかかわらず、PWK.APP/PS1マウスは、B6マウスよりも顕著に優れた認知回復力を持っていました。
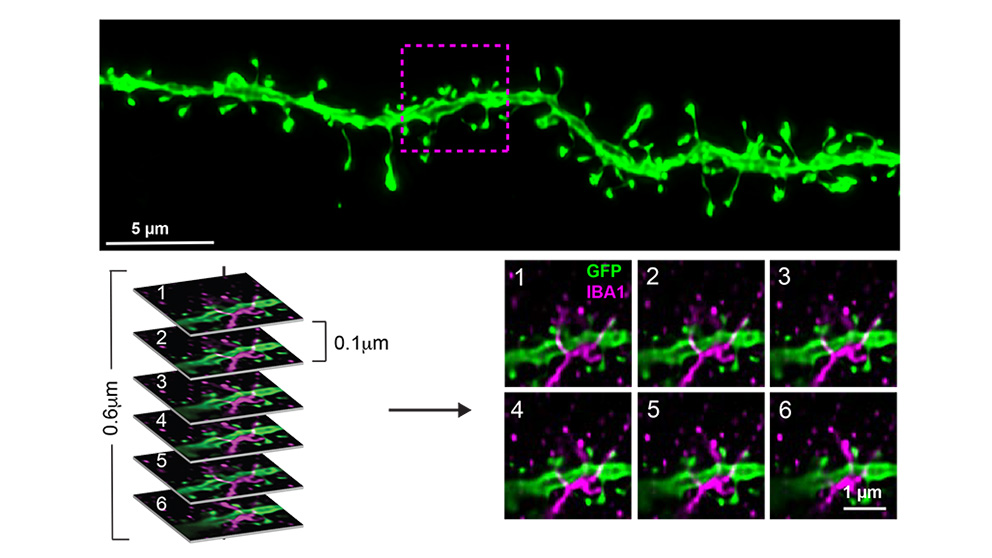
この認知機能の違いの原因を調査するために、研究チームは、海馬の領域を前頭前皮質に接続する、ADで障害されやすい特定の神経回路に注目しました。ミクログリア(ニューロンネットワークの維持と損傷の修復を助ける脳特異的免疫細胞)の活性化がアルツハイマー病に関係していることを考慮して、研究チームは、マウスの各グループの半数(B6; B6.APP/PS1; PWK; PWK.APP/PS1)にミクログリアを枯渇させるために、栄養補助食品を使用しました。一方、各グループの残りの半分には対照食を与えました。ミクログリアを枯渇させたいずれのマウスでも、ベータアミロイド斑の沈着に変化はありませんでした。
次に研究チームは、他のニューロンから信号を送受信するためのシナプスを形成する構造であるニューロン樹状突起スパインを観察しました。樹状突起スパインの密度を測定すると、シナプス数の近似値が得られ、一方、スパインの形態(構造)はシナプスの安定性と強度を示します。彼らは、健康な脳とβアミロイドにさらされた脳におけるミクログリアとシナプスの相互作用が遺伝的背景によって決まることを発見しました。ベータアミロイド斑の存在下ではB6のシナプスはスパインのサイズが小さく(安定性が低い)、一方、ミクログリアが存在しない場合はスパインのサイズが大きくなりました(安定性が高い)。PWKマウスでは同様の結果は見られず、PWKマウスのシナプスがβアミロイド斑の病態に対して一種の回復力を有することを示唆しています。さらに、B6マウスのスパイン密度の変化は、樹状突起分枝と直接接触しているミクログリアに依存していました。この関係はPWKマウスのミクログリアと樹状突起の相互作用には存在せず、PWKマウスが有するシナプスの回復力がミクログリアによるものではないことがさらに確認されました。
遺伝子で保護されているのか?
多くの研究者が、ADのリスクが他の人よりも高い人が存在する理由に注目してきましたが、最近では防御機構が注目されるようになっています。継続的に有酸素運動をしているとリスクが低いなど、行動や環境に関係するものもありますが、遺伝的な要因もあり、一般的にはAD発症を決定づける変異を持つ個人の発症を予防したり遅らせたりするものです。しかし、どのような分子メカニズムが機能して、これらの人々やPWKのような回復力のあるマウス系統を保護しているのか、また、より感受性の高い人々を助けるためにそれらの機構を標的にして予防的治療で強化できるかどうかを正確に確認するには、さらなる研究が必要です
「この結果に基づいて、私たちはPWK/PhJマウス系統をシナプスレベルと認知レベルの両方でのADに対する回復力のモデルとして指名します。私たちのADモデルでは、ミクログリアの枯渇はPWKのシナプス応答に影響を与えませんでしたが、現在、PWKの回復力を促す、細胞種に特有の他の要因を特定するために新たな研究を行っています。」とサラ・ホイヤーは語っています。
著者:
Mark Wanner
米国ジャクソン研究所Research Communications部門Associate DirectorのMark Wannerは、ジャクソン研究所の研究に関するコミュニケーションを統括しています。 サイエンスとコミュニケーション両方のバックグラウンドを持つMark Wannerは、さまざまな媒体で生物医学と臨床科学の問題を取り上げ、それらの情報を多くの視聴者層に発信するとともに、その問題について説明しています。
英語原文: Investigating how genetics affects Alzheimer's disease