新型コロナウイルス感染に対する患者のさまざまな反応が、遺伝的に多様なマウスで再現される
Research Highlight
By Mark Wanner
ジャクソン研究所の研究者は、新型コロナウイルス感染に対する非常に多様なヒトの反応を正確にモデル化する、遺伝的に多様なマウスのパネルを作成しました。研究チームはNIHのRocky Mountain Laboratoriesの共同研究者らと協力し、自然免疫反応及び制御された炎症性反応に関する違いを明らかにしました。これらの反応のタイミングと強さは、疾患の重症度と関連しています。今後、この多様なマウス系統により、科学者は新型コロナウイルス感染症の転帰における患者の差異をモデル化し、疾患の重症度のバイオマーカーの発見、抗ウイルス免疫反応の特徴付け、対策を評価するためのプラットフォームを提供できるようになるでしょう。
ヒトのさまざまな反応を再現する
新型コロナウイルス感染症パンデミックの初期に、このウイルスの感染に対する反応が人によって大きく異なることが明らかになりました。多くの人が全く症状を示さなかった一方で、数パーセントの人々は重度または致命的な状態になりました。微生物感染に対する細胞の防衛最前線である自然免疫活性およびインターフェロンシグナル伝達のタイミングと強さが、この違いに関与していると考えられていましたが、個人間の重症度を決定する根本的な要因は依然として十分に理解されていませんでした。
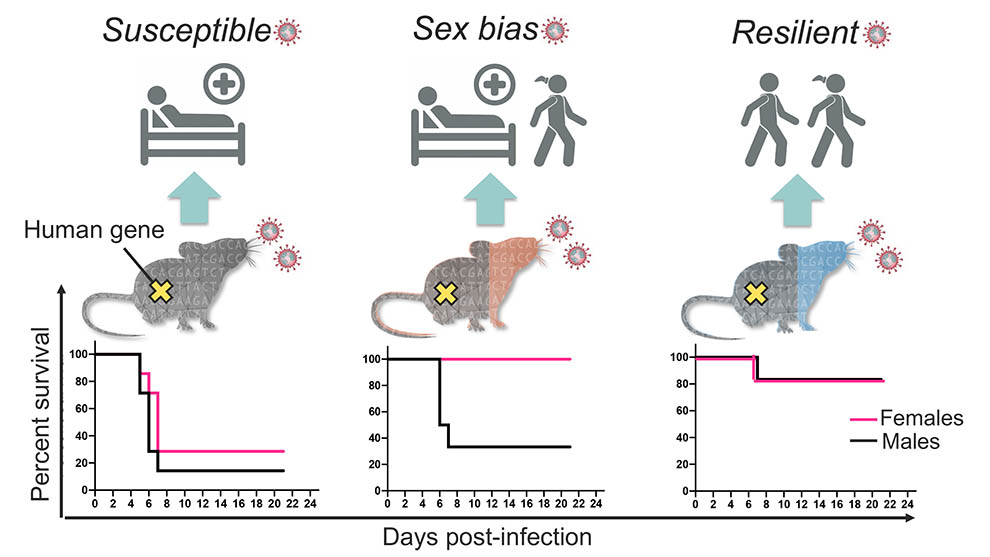
パンデミックを受けてマウスモデルのクリーン化を迅速に行ったところ、ヒト化アンジオテンシン変換酵素2(hACE2)受容体を介した新型コロナウイルス感染が可能となりました。当初、hACE2はK18-hACE2という単一の近交系マウスにのみ存在し、このマウスは常に重篤な疾患や致命的な疾患を発症しました。ヒトのさまざまな反応がマウスで再現できるかどうかを調べるために、ジャクソン研究所(JAX)のScientific DirectorでありProfessorでもある Dr. Nadia Rosenthal (ナディア・ローゼンタール)およびRocky Mountain National LaboratoriesのChief of Innate Immunity and PathogenesisであるDr. Sonja Best(ソーニャ・ベスト)が率いる研究チームは、オリジナルのK18-hACE2系統と、遺伝的に多様な他のマウス系統を交配しました。
Nature Communicationsに掲載された論文 「Genetically diverse mouse models of SARS-CoV-2 infection reproduce clinical variation in type I interferon and cytokine responses in COVID-19(新型コロナウイルス⦅SARS-CoV-2⦆感染の遺伝的に多様なマウスモデルは、新型コロナウイルス感染症⦅COVID-19⦆におけるI型インターフェロンおよびサイトカイン反応の臨床的差異を再現する」の中で、研究チームは、得られたF1(交配第一世代)マウスが実際に無症状から致死レベルまでのヒトの新型コロナウイルス感染症の重症度をモデル化したことを示しています。K18-hACE2マウス(C57Bl/6J)に使用したオリジナルの遺伝的背景は、感受性が非常に高かったのに対して、PWKという系統とのF1マウスは疾患に対して非常に高い耐性を持っていました。近交系A/J、129S1、NOD、NZO、CAST、WSB、BALB/c、およびDBA/2に由来する他の交雑種のF1世代は、ほとんどが上記の両極端な反応の中間にあたる様々な反応を示しました。興味深いことに、それらの一部(CAST、NOD、WSB)には性差もみられ、F1の雄と雌の間で一貫して疾患の重症度に差異が見られました。
前臨床プラットフォームの開発
研究チームは、このマウスパネルを使用して、患者におけるばらつきに関係すると考えられていた自然免疫反応の違いをさらに調査することができました。特に、1型インターフェロン(IFN-1)はウイルス複製の制御に不可欠であり、反応のタイミングと制御が疾患の重症度を左右する重要な役割を果たします。反応が遅れると、感染の初期段階にウイルスの複製と拡散が妨げられることなく進行する可能性があります。また、感染の急性期が終わった後に反応を制御してシグナル伝達を減少させることができない場合、炎症が持続したり、健康への悪影響が生じたりする可能性があります。
研究チームは、高耐性PWK F1マウスが肺内でのウイルス複製を早期に制御し、炎症反応の段階的な増幅と消散、および他の臓器へのウイルス拡散を防止したことを発見しました。対照的に、より感受性の高い系統との交配によるF1は、肺におけるIFN-1の発現効率が比較的低く、ウイルス複製を制御できず、炎症反応を制御できませんでした。例外はWSBで、初期のIFN-1発現量が多いだけでなく、肺における初期のウイルス量も多く、IFN-1発現量が少ないマウスと同様にクリアランスが遅れました。したがってWSBは、IFN-1発現量は多いものの抗ウイルス活性が低いことに関連するその他の病理学的反応を調査するのに有用である可能性があります。
私たちの現在の知識にはまだまだ不足している部分があります。自然免疫がウイルスを複製する具体的なメカニズム、炎症反応の適切な制御に必要なこと、性別により異なる疾患の重症度の分子メカニズム、組織修復および肺機能への長期的な影響などについてです。疾患の転帰と患者の遺伝的特徴を結び付けるための前臨床プラットフォームを開発することは、新型コロナウイルス感染症の感受性の根本的な違いに関する私たちの知識の欠落した部分を埋め、迅速な診断、メカニズムの研究、治療介入戦略のための正確なモデルの開発を促進してくれるでしょう。
著者:
Mark Wanner
米国ジャクソン研究所Research Communications部門Associate DirectorのMark Wannerは、ジャクソン研究所の研究に関するコミュニケーションを統括しています。 サイエンスとコミュニケーション両方のバックグラウンドを持つMark Wannerは、さまざまな媒体で生物医学と臨床科学の問題を取り上げ、それらの情報を多くの視聴者層に発信するとともに、その問題について説明しています。
英語原文: Variable patient responses to SARS-CoV-2 infection are mimicked in genetically diverse mice