好ましい結果に向けて局面を展開する
Research Highlight
カテゴリー:血液
By Mark Wanner

Dr.ジェニファー・トローブリッジ(ジャクソン研究所にて2019年撮影)
写真提供:Tiffany Laufer
Cancer Discoveryに掲載された論文で、ジャクソン研究所のDr. Jennifer Trowbridge(ジェニファー・トローブリッジ)と彼女のチームは、クローン性造血に最も関連する分子シグナル伝達経路を明らかにするとともに、その経路内の特定の細胞表面受容体を遮断することが、いかに健康に良い変化をもたらすかを明らかにしました。
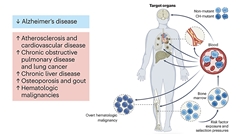
造血幹細胞(HSC)は骨髄に存在する必要不可欠な細胞であり、生涯を通じてすべての血液細胞(赤血球ならびに自然免疫細胞と適応免疫細胞の両方)を生成します。しかし、年齢を重ねるにつれて、遺伝子変異を有する細胞やゲノムが破壊された細胞が蓄積される可能性があり、HSCでも例外ではありません。これらの遺伝的変化のいくつかにより、HSCが選択的に増殖されやすくなる可能性があり、骨髄内の変異細胞の割合が増加し、クローン性造血と呼ばれる状態につながります。クローン性造血は、血液がんなどの健康リスクを増大させる場合もある一方で、アルツハイマー病などの加齢関連疾患のリスクを低下させる場合もあります。
ジャクソン研究所(JAX)のAssociate Professorであり、ダッテルズ・ファミリー寄付講座の教授である Dr.ジェニファー・トローブリッジ は、クローン性造血と、一定の人々においてクローン性造血が未だ予測不可能にがんに至るメカニズムを調査しています。米国癌学会の機関誌である Cancer Discoveryに掲載された論文 「Distinct Tumor Necrosis Factor Alpha Receptors Dictate Stem Cell Fitness Versus Lineage Output in Dnmt3a-Muntant Clonal Hematopoiesis(特異的な腫瘍壊死因子アルファ受容体は、Dnmt3a変異の認められるクローン性造血において幹細胞が分化する際の適応度を決定する)」でDr.トローブリッジは、健康に良い結果や悪い結果をもたらす可能性のある、ある受容体に特異的なモデルを提示しています。この結果は、血液細胞がクローン性に増殖することに関連する疾患を軽減するための治療標的となるものを示唆しています。
すべてのシグナル伝達が同一ではない
以前の研究では、DNAメチルトランスフェラーゼ遺伝子であるDNMT3Aの変異が、骨髄のクローン性造血を促進する可能性があると示されています。Dr.トローブリッジと彼女の研究チーム(ポスドクアソシエイトで筆頭著者の Dr. Jennifer SanMiguel(ジェニファー・サンミゲル) を含む)は、マウスのDnmt3a遺伝子に特定の変異を持つマウスモデルを使用して、クローン性造血のメカニズムを調査しました。当研究チームは、Dnmt3a変異マウスと野生型(正常)マウスのHSC間の遺伝子発現の違いを分析し、シグナル伝達分子である腫瘍壊死因子アルファ(TNFα)が最も豊富な遺伝子シグネチャーを持っていることを発見しました。当研究チームはまた、若いマウスと比較して、高齢のマウスの骨髄でTNFαが増加していることも発見しました。全体として、本研究の知見は、TNFαシグナル伝達の増加が、マウスとヒトの両方において、DNMT3A変異を有するHSCの選択的優位性と相関していることを示しています。
一般に、TNFのシグナル伝達は、細胞増殖、分化、および炎症を含む免疫応答の調節に関与しています。具体的には、TNFαはTNFR1およびTNFR2として知られる、いずれもHSCに発現している2つの異なる受容体と結合することで機能します。この2つの受容体がDnmt3a関連クローン性造血において同様の役割を果たすかどうかを検討するために、Dr.トローブリッジと彼女の研究チームは、TNFR1またはTNFR2のいずれかを欠くマウスを作成しました。興味深いことに、TNFR2ではなくTNFR1が存在しない場合、遺伝子変異を有するHSCはその選択的優位性を失いました。一方、TNFR1ではなくTNFR2の欠失は、リンパ系(適応)免疫細胞の割合を減少させ、骨髄系(自然)免疫細胞の割合を増加させました。骨髄細胞の割合が相対的に高いことは、炎症とそれに伴う健康への悪影響に関連しています。
治療法の微調整
一般に、TNFのシグナル伝達を阻害する治療は、炎症のリスクの増加など、深刻な副作用をもたらす可能性があります。当研究チームは、そのような治療がDnmt3a変異を有するHSCの増殖力の強さを低下させる一方で、骨髄細胞の産生を増加させることも発見しました。しかし、変異型HSCの特定のTNFα受容体(TNFR1)を標的にすると、変異型HSCの選択的優位性が低下するとともに、リンパ系細胞の産生が増加し、適応免疫機能が高まる可能性があります。この研究結果は、TNFR1を遮断する戦略が、クローン性造血の転帰を好ましいものへと変え、癌や他の疾患に進行するリスクが高い人々に有用である可能性があることを示唆しています。
英語原文 https://www.jax.org/news-and-insights/2022/September/tipping-the-scale-toward-favorable-outcomes